2010年9月21日

左から堀江貴裕 医学研究科
産官学連携助教、尾野講師
尾野亘 医学研究科講師らの研究グループの研究成果が米国科学アカデミー紀要(オンライン版)に掲載されました。
研究成果の概要
細胞内コレステロールレベルを厳密にコントロールすることは細胞生存にとって大変重要である。Sterol regulatory element-binding protein 2 (SREBP-2)は細胞内のコレステロールの低下を感知して、細胞がコレステロール不足になることを防ぐ働きがある。すなわち、コレステロール合成や取り込みに関わる遺伝子を正に制御し、また末梢の細胞においてはコレステロールの引き抜きに関わるATP-binding cassette transporter A1 (ABCA1)を負に制御する。また、内在性の低分子RNAであるマイクロRNA (microRNA:miRNA)が、遺伝子発現を精巧に調節していることが示されてきた。我々はSrebp2のイントロンに存在するmiR-33欠損マウスを作成し、miR-33がSREBP-2と同様にABCA1の蛋白翻訳を負に制御していること、またその結果、血中HDLの低下に関わることを示した。すなわち、miR-33欠損マウスにおいては、マクロファージおよび肝臓においてその標的遺伝子であるABCA1の蛋白発現が上昇し、マクロファージでのApoA-Iに対するコレステロール引き渡しが増加すること、また血中HDLがオスで22%、メスで39%増加することを見いだした(Horie T, Ono K*(*corresponding author), et al. Proc Natl Acad Sci U S A. 2010 in press.)。
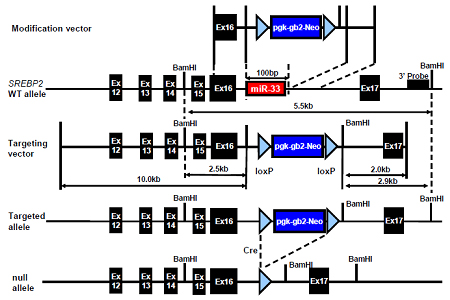
- 図1: microRNA-33ノックアウトマウスの作成
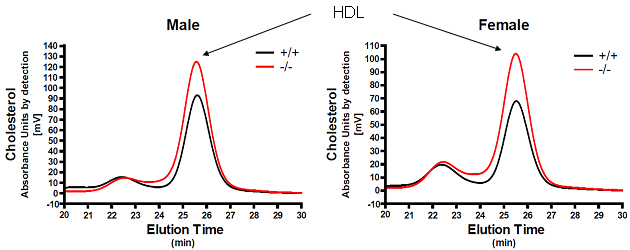
- 図2: microRNA-33ノックアウトマウスでは野生型にくらべてHDLコレステロールが上昇する
ヒトではさらに、中性脂肪の合成に関わるSREBP-1のイントロンにmiR-33bが存在している。SREBP-1,2の両者が活性化されている場合(スタチン服用中の肥満者など。現在最も広く脂質異常症の治療で使用されているスタチンはコレステロール合成を抑制する作用がある。このために、SREBP2の転写が上昇し、miR-33a (マウスのmiR-33に相当)発現が上昇する。一方肥満者においては血中インスリンレベルが高く、そのためにSREBP1発現が上昇し、miR-33b発現が上昇する)においては、miR33a/b系が増強し、HDLが上昇しにくい状況であると考えられる。従って、血中LDLコレステロールの低下を目標に、脂質異常症(高コレステロール血症)の治療をスタチンで受ける場合(特に肥満者)では、microRNA-33を同時に抑制すれば、LDLが下がり、HDLが上昇するという理想的な治療が行えることになる。
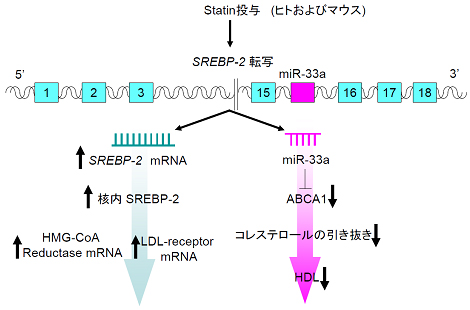
- 図3: スタチン投与と血中HDLの関係
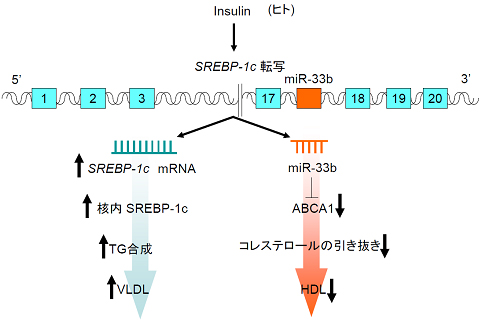
- 図4: 肥満と血中HDLの関係
関連リンク
- 論文は、以下に掲載されております。
http://dx.doi.org/10.1073/pnas.1008499107
http://hdl.handle.net/2433/131809(京都大学学術情報リポジトリ(KURENAI))
- 朝日新聞(9月28日 32面)、京都新聞(9月21日 22面)、日刊工業新聞(9月21日 23面)、日本経済新聞(9月21日 30面)および読売新聞(9月21日 2面)に掲載されました。

