2009年7月2日

左から李特任講師、篠原教授
李知英(り じよん) 東京医科歯科大学歯と骨のGCOE拠点特任講師(元京都大学大学院医学研究科分子遺伝学分野助教)、篠原隆司 京都大学大学院医学研究科教授らの研究チームは、マウス精巣から採取した精子幹細胞を用いて特定の遺伝子の導入により精原幹細胞の自己複製分裂を試験管内で再構築する事に成功しました。
この結果は6月29日の週の米国科学雑誌「Cell Stem Cell」誌(電子版)に掲載される予定です。
論文名:
- Lee, J., Kanatsu-Shinohara, M., Morimoto, H., Kazuki, Y., Takashima, S., Oshimura, M., Toyokuni, S. and Shinohara, T. Genetic reconstruction of mouse spermatogonial stem cell self-renewal in vitro by Ras-cyclin D2 activation.
研究成果の概要
マウスの精原幹細胞の培養株であるGS(Germline Stem)細胞は精子形成の源になる細胞で、自己複製分裂して精子形成する能力を持つ細胞です。2003年に篠原教授らのグループは精子幹細胞の長期培養法を報告しました(Biology of Reproduction, vol 69, p612, 2003)。通常この細胞の培養には複数の異なる増殖因子が必要ですが、今回はGS細胞に特定の遺伝子としてRasもしくはサイクリン遺伝子(CyclinD2/E1との組み合わせ)を導入することによって、試験管内でCytokineなしの条件で精子幹細胞の自己複製の再構築に成功しました。また、このように自己複製を過剰に刺激された幹細胞は、精巣内においてはがん幹細胞へと変化し、腫瘍を形成することも明らかになりました。従って、今回の研究の成果は精子幹細胞の自己複製機構を明らかにしたと共に、腫瘍形成と自己複製との密接なつながりも指摘した点で、今後の幹細胞研究に重要な影響を与えるものです。また我々の研究成果は、不妊治療や精巣癌などの生殖細胞腫瘍の治療技術の開発促進にも役に立つと考えられます。
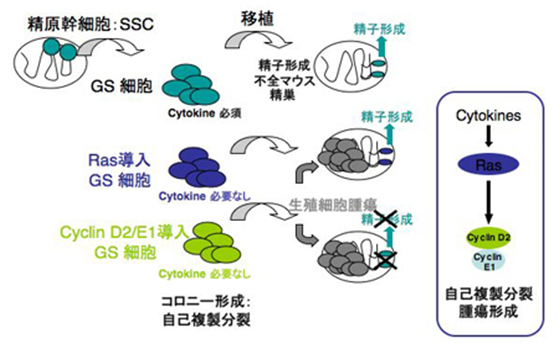
図 研究成果の概要図
本研究は科学技術振興機構CREST、文部科学省科学研究費補助金のサポートをうけ、鳥取大学大学院医学系研究科(押村光雄教授)、名古屋大学大学院医学系研究科(豊國伸哉教授)らとの共同研究によるものです。
これまでの研究の状況
これまで精原幹細胞の自己複製分裂分子機構に関しては、精子幹細胞の数が少なくさまざまな増殖因子が関与するため、生化学的または分子生物学的解析は非常に困難でした。
篠原教授らのグループは、この問題を解決するためには幹細胞を長期に増幅する技術が必要だと考え、2003年に精子幹細胞の長期培養法を初めて報告しました。この方法では、精巣細胞をGlial cell line –derived neurotrophic factor(GDNF=精子幹細胞の自己複製因子)およびbasic fibroblast growth factor(bFGF)の存在下で培養すると、ES細胞とは異なる形態をもつ精子幹細胞コロニーを誘導することができ、培養された精子幹細胞は2年以上の期間にわたり対数増殖します。培養精子幹細胞は、精巣内に移植すると精子を作り、メスとの交配によって正常な子孫を産生することも確認されています。これらの性質に因み、この培養精子幹細胞はGermline Stem(GS)細胞と命名されました。
篠原教授らは次のステップとして、このGS細胞を用いて精子幹細胞の自己複製に作用する分子を探すため研究を行いました。鋭意努力の結果、ES細胞の多能性維持に重要な役割をするAktをGS細胞に導入してAktを活性化すると、そのGS細胞は自己複製因子であるGDNFの非存在下で自己複製分裂することを明らかにし、その成果を2007年にDevelopment誌に発表しました。しかしながら、Akt単独では、GS細胞は完全に自己複製を誘導することができず、外来のbFGFのシグナルを必要とすることから、Akt以外にも精原幹細胞の自己複製を引き起こす分子が存在することが分かりました。そこで、篠原教授らは研究をさらに継続し、今回の研究でRasもしくはその下流分子であるサインクリン遺伝子をGS細胞に導入する事によって、完全なCytokineなしの条件で精子原幹細胞の自己複製を人工的に再構築する事ができました。これらの結果から、AktにはなかったbFGFと同等のシグナルをRasもしくはサイクリンが与えていることが分かりました。Rasは当初がん遺伝子として発見されましたが、同時に正常な細胞の増殖や分化にも重要な役割を果たすことが知られています。しかしながら、これまで精原幹細胞におけるRasの役割の機能的解析は行われていませんでした。
RasもしくはCyclin D2/E1が導入されたGS細胞から生殖細胞腫瘍(Germ cell tumor; GCT)が発生したことは、今回の研究成果のもう一つの重要な点です。Ras導入細胞は正常な精子形成を移植初期に示すものの、3ヶ月後には癌として周囲の組織に浸潤し、悪性化しました。一方、Cyclin D2/E1-GS細胞は精巣の中で精子へ正常な分化ができず、未分化細胞の集団のみからなる良性腫瘍を形成することから、Cyclinは精子幹細胞において組織維持と腫瘍形成の間の微妙なバランスを取り、腫瘍形成の初期に関与することが予想されます。興味深いことに、この両タイプの腫瘍はいずれも再度別のマウスに移植しても同じ表現型を示す腫瘍を形成することから、「がん幹細胞」が含まれていることも明らかになりました。
実際にこれまでの研究で、RasおよびCyclinD2の突然変異は、ヒトにおいても多くの生殖細胞腫瘍に見いだされています。残念ながら、これらの遺伝子の変化が腫瘍化の直接の原因なのか、二次的な変化であるのかは、適当な解析手法がなかったために明らかにされていませんでした。マウスにおいては、これと類似の生殖細胞腫瘍モデルとして、GDNFの過剰発現トランスジェニックマウスがヒトの古典的な未分化腫瘍(Seminoma)を発症することが2000年に報告されています。しかし、このモデルでは、腫瘍形成に7ヶ月から1年という長い時間がかかり、導入したGDNF遺伝子が体細胞と生殖細胞に同時に発現しているので、腫瘍の初期段階またはその腫瘍の原因(起原)を解析することは困難でした。今回の研究ではGS細胞を用いることで、幹細胞における自己複製機構の過剰な活性化ががん幹細胞とそれから生じる腫瘍を誘導することが証明できました。これは幹細胞を腫瘍に直接変化させることができた点で、極めて新しい成果です。
医療・バイオテクノロジーへの貢献
遺伝子操作による精子幹細胞自己複製機構の再構築実験の結果は、これまで詳細な分子生物学的解析が非常に難しかった組織幹細胞の自己複製機構またはがん幹細胞研究などの関連分野に重要な知識を提供し、その研究の促進に役に立つことが期待されます。
自己複製シグナルの過剰な刺激がどのように生殖細胞腫瘍を誘導したのかは、今後の基礎的な解析が必要です。しかし、今回の研究で生殖細胞腫瘍の初期段階、悪性化のモデルを作製することができたことから、RasとCyclin D2/E1-GS細胞が移植されたマウスは、生殖細胞腫瘍モデルとして利用される可能性が出てきました。これらのマウスの解析により、ヒト精巣癌の病因およびその治療に関する新たな知見を得ることができると予想されます。また、精子幹細胞の増殖機構の解明は、ヒト男性不妊治療にも役立つものと考えられます。
- 京都新聞(7月2日 23面)および日刊工業新聞(7月2日 23面)に掲載されました。

