2009年3月30日
科学技術振興機構(JST)
京都大学

浜地 格 教授
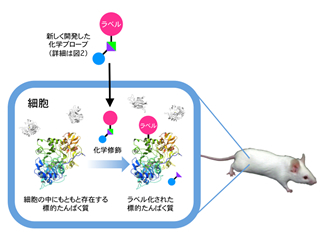
JST基礎研究事業の一環として、京都大学の浜地 格 教授らは、特定のたんぱく質を狙って、それが存在する細胞内や生体内環境で、そのたんぱく質の機能を損なうことなく、選択的に目印(ラベル)を付けることができる化学プローブ分子を世界で初めて開発しました。
従来、化学的な手法によるたんぱく質のラベル・修飾は、選択性が低く、細胞内のたんぱく質には使えないと考えられてきました。そのため、オワンクラゲの蛍光たんぱく質(GFP)に代表されるような特種なたんぱく質を遺伝子上であらかじめ目的たんぱく質に融合させ、それを細胞内に発現させるという分子生物学的手法が用いられてきました。しかし、この遺伝子操作によって改変させたたんぱく質は、本来の自然な細胞とは異なる状態を誘導する可能性があるため、遺伝子操作が不要でかつ選択性の高い化学的な方法の開発が望まれていました。
同研究グループは今回、導入したいラベルに標的たんぱく質へのターゲティング能を付与した化学プローブ分子を設計しました。さらに、これまでたんぱく質の修飾反応としては利用されていなかったトシル化学と呼ばれる化学反応を用いることによって、細胞内や生物個体内でもその機能を損なうことなく、狙ったたんぱく質を選択的にラベル化する手法を開発しました。
この手法は、細胞内や生体内というたんぱく質や酵素が実際に働いている、より自然に近い状態での観察やイメージングを可能にすることから、たんぱく質に対する理解を促進するだけでなく、異常たんぱく質の検出による病気の診断、細胞内で構築されたバイオセンサーを用いた創薬開発などにも役立つと考えられます。また将来的には、異常をきたした酵素やたんぱく質を直接修復することができる化学技術へと発展することも期待されます。
本研究成果は、2009年3月29日(英国時間)に英国科学雑誌「Nature Chemical Biology」のオンライン速報版で公開されます。
論文名:
- “Ligand-directed tosyl chemistry for protein labeling in vivo”
(生体内でたんぱく質選択的なラベリングを可能とするリガンド指向性トシル化学)
研究の背景と経緯
たんぱく質や酵素は生命維持をはじめ、あらゆる生命現象を支える主役の1つであるために、その機能や構造の理解はライフサイエンスにおける大変重要な課題です。またそれらの異常は直接病気につながることが多いので、たんぱく質や酵素の状態変化や異常を正確に検出・分析することは、病気の診断や予防にもつながると考えられています。最近では、その働きを理解し、異常を検出するためには、それらを試験管の中に取り出して調べるだけでなく、実際にたんぱく質や酵素が存在し、機能を発揮している細胞や生体の中でそのまま直接見ることが重要と考えらえるようになってきました。
このために、昨年の下村 脩氏のノーベル化学賞受賞の対象となったオワンクラゲの蛍光たんぱく質(GFP)を用いた細胞内でのたんぱく質の蛍光イメージング技術が広く活用されています。ところが、GFPを使った方法も含めて従来の手法では、いったんたんぱく質の設計図である遺伝子を改変してGFPなどの目印を付けた融合たんぱく質となるようにし、これを細胞に戻して調べなければなりません。そのため、本来の自然な細胞環境とは異なる現象を観察してしまう恐れが常にあるうえ、元から細胞にあったたんぱく質の様子をそのまま調べることは不可能でした。遺伝子操作を加えることなく、そのままの細胞環境で、狙ったたんぱく質に、その働きを阻害することなく目印を付けることができれば、真に生体環境に近い状態で存在するたんぱく質の観察や分析ができることになると期待されていましたが、そのような手法はこれまでありませんでした。
研究の内容
本研究グループは、これまで選択性が低いため、あるいは、たんぱく質機能を阻害してしまうために使えなかった化学的手法を飛躍的に発展させて、細胞内や生物個体内で狙ったたんぱく質に選択的に目印(ラベル)を付け、またその目印を利用することによってたんぱく質をバイオセンサーのような新しい機能性たんぱく質へ変換できる化学的方法論を世界で初めて開発することに成功しました。
具体的には、以下に述べるような分子設計を施した化学プローブと呼ばれる数ナノメートルサイズの小さな分子を作り、これを化学ツールとして用いました。まず、導入したい目印にたんぱく質をターゲットする部品(リガンド)を付けて標的たんぱく質に選択的に相互作用する能力を付与しました。その際、目印とリガンドをトシル基と呼ばれるフェニルスルフォネート結合を介して連結しました。こうすることで、この化学プローブは標的たんぱく質と相互作用したときにのみそのたんぱく質と反応を起こすことができ、また、たんぱく質をラベル化(目印付け)すると同時に、たんぱく質ターゲットに使われたリガンド部位が切り離される仕組みになっています。この化学プローブは、細胞の外から内側へ侵入し、細胞内に存在する多種多様な成分の中から標的となるたんぱく質に選択的に近づき、そのたんぱく質の表面に目印をつけることを可能にしました。
このラベル化は、試験管の中での精製したたんぱく質に対してだけでなく、(培養)細胞内やマウスの体内でも起こることも分かりました。また、ラベル化によって たんぱく質を蛍光で光らせることや磁気イメージングできるMRI活性にすることもでき、これらのたんぱく質は細胞内で特定の分子と結合し、それらの存在の有無を読み出すことができるバイオセンサーとして機能することも確かめました。
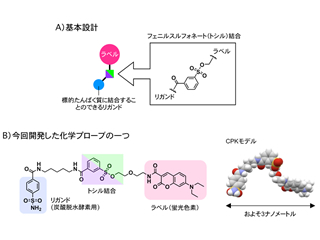 図2 新しく開発したナノメートルサイズの化学プローブの分子設計指針と実際の化学構造式およびその化学プローブ分子の形 | 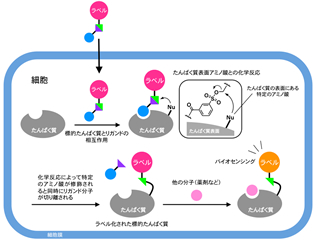 図3 化学プローブが細胞内に侵入し特定のたんぱく質だけに目印を付け、かつ、そのたんぱく質をバイオセンサーへと機能変換する様子を示す、より詳細な模式図 |
今後の展開
この技術は、より生体環境に近い状態でのたんぱく質や酵素の観察、解析を可能とするため、生体内での種々のたんぱく質や酵素の存在場所や役割の理解を促進するだけでなく、細胞内バイオセンサーの構築を容易にすることにつながり、それらを用いた創薬開発を容易にすると考えられます。また、異常をきたしたたんぱく質のイメージングや検出による疾病の診断などへと応用されることが期待できます。さらに将来的には、細胞内や生体内で異常をきたしたたんぱく質や酵素の選択的な分解や修復を可能とする化学的手法の開発を促す契機となることも期待されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「プロセスインテグレーションに向けた高機能性ナノ構造体の創出」
(研究総括:入江 正浩 立教大学 教授)
研究課題名:動的応答特性を有するナノ構造体の構築と精密バイオ機能化
研究代表者:浜地 格(京都大学 大学院工学研究科 教授)
研究期間:平成20年10月~平成25年9月
JSTはこの領域で、自己組織化に代表される従来のボトムアッププロセスに、分子レベルでの精緻な機能を利用して自訴構造化や自己修復などの新たな手法を取り込んで一段の高度化を図ることによって新規高機能性ナノ構造体の創出を目指しています。上記研究課題では、細胞の内部に侵入しその状態を精密にセンシングしたり、その働きを制御したりすることができる動的なナノ構造体の創製を目標に研究を展開しています。
- 科学新聞(4月10日 4面)、京都新聞(3月30日 28面)、産経新聞(3月30日 28面)、日刊工業新聞(3月30日 23面)および日本経済新聞(3月30日 13面)に掲載されました。