2008年9月4日

左から有吉 眞理子 助教、白川 昌宏 教授
白川 昌宏 工学研究科 教授らの研究グループの研究成果が、英国科学誌「ネイチャー」電子版に掲載されることになりました。
研究成果の概要
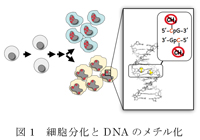 私たちの体は数多くの種類の細胞から出来ている。これらの細胞は、例えば神経細胞、皮膚細胞、筋肉細胞などを比べても判るように、形状、機能、サイズなど様々な点で大きく異なる。しかしこれらの細胞は全て同一なゲノムDNA配列を持っており、ひとつの受精卵から細胞分化の過程を経て出来上がったものである。では、なぜ同じゲノム配列を持つ細胞がかくも異なるのだろうか?それは細胞によって機能している遺伝子(遺伝子発現)が異なるからである。この遺伝子発現の調節で最も重要な役割を果たすものの一つがDNAのメチル化である。ゲノムDNA中のCG配列上のシトシン塩基がメチル化を受けるとその部分の遺伝子が抑制される、すなわち“鍵がかかった"状態になる。そして細胞の種類によって鍵がかかる場所が異なっている (図1)。すなわちゲノム上のメチル化パターンが細胞分化の決定要因となっている。一方、”未分化な”細胞状態であるES細胞やiPS細胞では、分化した細胞とは異なる、特有のメチル化パターンを持つ事が最近の研究から明らかになっている。そしてDNAメチル化はiPS細胞の樹立に最も重要な要素の一つだと考えられつつある。
私たちの体は数多くの種類の細胞から出来ている。これらの細胞は、例えば神経細胞、皮膚細胞、筋肉細胞などを比べても判るように、形状、機能、サイズなど様々な点で大きく異なる。しかしこれらの細胞は全て同一なゲノムDNA配列を持っており、ひとつの受精卵から細胞分化の過程を経て出来上がったものである。では、なぜ同じゲノム配列を持つ細胞がかくも異なるのだろうか?それは細胞によって機能している遺伝子(遺伝子発現)が異なるからである。この遺伝子発現の調節で最も重要な役割を果たすものの一つがDNAのメチル化である。ゲノムDNA中のCG配列上のシトシン塩基がメチル化を受けるとその部分の遺伝子が抑制される、すなわち“鍵がかかった"状態になる。そして細胞の種類によって鍵がかかる場所が異なっている (図1)。すなわちゲノム上のメチル化パターンが細胞分化の決定要因となっている。一方、”未分化な”細胞状態であるES細胞やiPS細胞では、分化した細胞とは異なる、特有のメチル化パターンを持つ事が最近の研究から明らかになっている。そしてDNAメチル化はiPS細胞の樹立に最も重要な要素の一つだと考えられつつある。
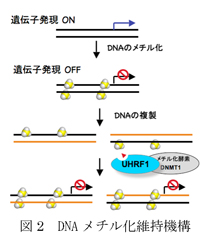 細胞は一度分化するとその分化状態は固定する。例えば皮膚細胞は分裂すると皮膚細胞になるのであって、神経細胞や血球細胞などにはならない。これは、DNA複製に伴ってメチル化パターンが正確に継承される事で、細胞分化状態が維持されるからである(図2)。この機構が破綻すると病的な未分化状態である癌細胞になり、逆に上手に脱分化が達成されるとiPS細胞となると捉える事ができる。
細胞は一度分化するとその分化状態は固定する。例えば皮膚細胞は分裂すると皮膚細胞になるのであって、神経細胞や血球細胞などにはならない。これは、DNA複製に伴ってメチル化パターンが正確に継承される事で、細胞分化状態が維持されるからである(図2)。この機構が破綻すると病的な未分化状態である癌細胞になり、逆に上手に脱分化が達成されるとiPS細胞となると捉える事ができる。
今回の研究は、細胞分裂においてDNAメチル化が精密に娘細胞に受け継がれ、細胞の分化状態が維持される仕組みを、タンパク質とDNAの立体構造を原子レベルで解析することで、明らかにした。
DNA2重らせんは両方の鎖がメチル化を受けている。しかしDNA複製直後は、鋳型となった鎖はメチル化されているが、新生鎖はメチル化を受けていないため”片鎖メチル化“状態となる(図2)。この片鎖メチル化はUHRF1というタンパク質により認識されて、さらにDnmt1という酵素によって新生鎖がメチル化されることで”両鎖メチル化”状態となる。従ってUHRF1による片鎖メチル化の正確な認識が、DNAメチル化そして細胞分化状態の維持に最重要となる。
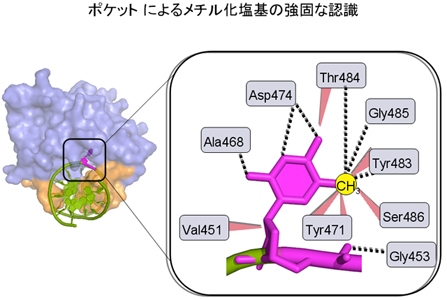
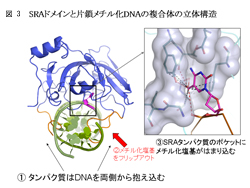 我々は、UHRF1のDNA認識を担うSRAドメインと片鎖メチル化DNAの複合体の立体構造を決定した。SRAドメインは構造変化を起こして両側から抱きかかえるようにしてDNAと結合する。面白い事に、片鎖メチル化DNAのメチル化された塩基は2重らせんの外に引き出されて、タンパク質のポケットにはまり込んでいる(図3)。メチル化された塩基はポケット内でタンパク質と多くの相互作用をする事で精密に認識される。そしてこのポケット内での厳密な認識こそが、巨大なゲノムDNAに点在するメチル化部位を短時間のDNA複製期間中に忠実に受け継がせる事を可能にしている。DNAを修復・修飾する酵素がこのような塩基の2重らせんからのフリップアウトを行う事は知られているが、塩基認識のためにのみ行うことが判ったのはSRAドメインが始めてであり、この分子認識の重要性を物語っている。
我々は、UHRF1のDNA認識を担うSRAドメインと片鎖メチル化DNAの複合体の立体構造を決定した。SRAドメインは構造変化を起こして両側から抱きかかえるようにしてDNAと結合する。面白い事に、片鎖メチル化DNAのメチル化された塩基は2重らせんの外に引き出されて、タンパク質のポケットにはまり込んでいる(図3)。メチル化された塩基はポケット内でタンパク質と多くの相互作用をする事で精密に認識される。そしてこのポケット内での厳密な認識こそが、巨大なゲノムDNAに点在するメチル化部位を短時間のDNA複製期間中に忠実に受け継がせる事を可能にしている。DNAを修復・修飾する酵素がこのような塩基の2重らせんからのフリップアウトを行う事は知られているが、塩基認識のためにのみ行うことが判ったのはSRAドメインが始めてであり、この分子認識の重要性を物語っている。
この研究成果は細胞分化を維持する仕組みの一端を詳細に明らかにすると同時に、細胞の癌化やiPS細胞といった、細胞の脱分化に関わる生命現象の理解とその人為的制御に重要な知見を与える。例えば、UHRF1は発癌の関連遺伝子としても知られ、UHRF1と共に働くDnmt1は重要な抗がん剤のターゲットとみなされている。またごく最近Dnmt1の阻害剤がiPS細胞の産生効率を大幅に上昇させると報告されている。今回の研究成果は、これらの分野の理解と応用にも寄与するものと期待が持たれる。 (本研究は京都大学工学研究科 白川 昌宏 教授・有吉 眞理子 助教のグループが中心となり、東京大学医科学研究所 中村祐輔教授と共同で行われた。)
- 朝日新聞(9月8日 23面)、京都新聞(9月4日 24面)、産経新聞(9月5日 22面)、日刊工業新聞(9月4日 22面)、日本経済新聞(9月4日夕刊 20面)、毎日新聞(9月4日 3面)および読売新聞(9月4日 2面)に掲載されました。

