奥野恭史 医学研究科教授、中奥敬史 国立がん研究センター研究所研究員、河野隆志 同分野長、後藤功一 国立がん研究センター東病院科長らの研究グループは、東京大学、理化学研究所、英国クリック研究所と共同で、分子標的治療薬・バンデタニブによって治療されたRET融合遺伝子陽性の肺がん患者のがん試料の機能ゲノム解析を行い、新しい薬剤耐性メカニズムを発見しました。
本研究結果は、2018年2月12日付けで米国の学術雑誌「Nature Communications」に発表されました。
研究者からのコメント
がんのゲノム医療やゲノム研究が進むにつれて、がん細胞のゲノムには、多くの遺伝子変異が生じていることが明らかになっています。しかしながら、それらの多くは、がん化や治療に関する意義がわからないVUS(variants of unknown significance:意義不明変異)です。今回の研究に用いた手法は、これら意義不明変異を解明し、治療の方針決定の手助けになると期待されます。
本研究成果のポイント
- 薬剤結合部位と離れた位置に生じた遺伝子変異が薬剤への耐性獲得の原因となる。
- 薬剤耐性は、遺伝子変異を引き金とするアロステリック(タンパク質構造を協調的に変化させる)効果によって引き起こされ、酵素活性の上昇と薬剤結合の低下をもたらす。
- アロステリック効果は、スーパーコンピュータ「京」などを用いた分子動力学シミュレーションで推定できる。
- 本研究の手法は、がんゲノムに見られる意義不明変異の解明に役立つ可能性がある。
概要
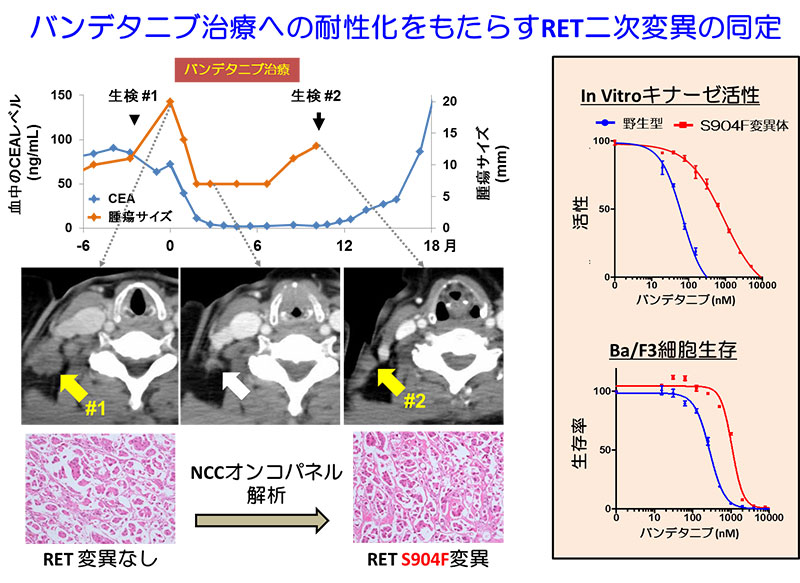
日本におけるがん死因の1位は肺がんです。現在、日本で年間に約11万人が肺がんを発症し、約7万人が肺がんで死亡しています。肺がんの約85%を占める非小細胞肺がんにおいては、約2/3の患者が手術不能の進行がんとして発見され、遺伝子異常にもとづく分子標的治療が有力な治療手段の一つとなっています。しかしながら、がん細胞が獲得する分子標的治療薬への耐性の獲得が、治療効果の大きな障壁となります。
薬剤耐性は、EGFR遺伝子変異肺がんにおける二次変異(T790M変異)など、薬剤や酵素の基質であるアデノシン3リン酸の結合部位に生じる変異が主な原因として知られています。今回の研究では、バンデタニブ治療に耐性となる前と後の患者の肺がんのゲノムDNAについて、次世代シークエンサーを用いた遺伝子パネル検査(NCCオンコパネル検査)を行うことで、RET融合タンパク質の薬剤の結合部位から離れた位置に存在する活性化ループ上に耐性化をもたらす二次変異を発見しました。
X線構造解析、スーパーコンピュータ「京」などを用いた分子動力学シミュレーションなど複合的な解析を行ったところ、この変異は、遠隔的にRETタンパク質の薬剤や基質であるアデノシン3リン酸の結合部位となる領域の3次元構造を変化させる効果(アロステリック効果)を持つことが示されました。これにより、変異タンパク質では酵素活性の上昇と薬剤結合の低下が生じ、薬剤に耐性となると考えられます。
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.1038/s41467-018-02994-7
【KURENAIアクセスURL】 http://hdl.handle.net/2433/229494
Takashi Nakaoku, Takashi Kohno, Mitsugu Araki, Seiji Niho, Rakhee Chauhan, Phillip P. Knowles, Katsuya Tsuchihara, Shingo Matsumoto, Yoko Shimada, Sachiyo Mimaki, Genichiro Ishii, Hitoshi Ichikawa, Satoru Nagatoishi, Kouhei Tsumoto, Yasushi Okuno, Kiyotaka Yoh, Neil Q. McDonald & Koichi Goto (2018). A secondary RET mutation in the activation loop conferring resistance to vandetanib. Nature Communications, 9, 625.





