桝田哲哉 農学研究科助教、岩田想 医学研究科教授(理化学研究所グループディレクター)、菅原道泰 理化学研究所特別研究員、鈴木守 大阪大学准教授、登野健介 高輝度光科学研究センターチームリーダーらの共同研究グループは、X線自由電子レーザー(以下、XFEL:X-ray Free-Electron Laser)施設「SACLA」を用いた「連続フェムト秒結晶構造解析(以下、SFX)」という手法を使い、酵素の一種である「プロテイナーゼK」の構造を原子分解能(原子間結合距離(1.20オングストローム)以下の分解能)での解析に成功しました。SFXを用いて原子分解能で構造決定した初めての成果です。
本研究成果は、2017年3月31日午後6時に英国の科学雑誌「Scientific Reports」に掲載されました。
研究者からのコメント
測定条件を見出すのに時間を要したものの、4時間程度で構造解析に必要な82,000枚の回折データを取得できました。本手法を用いた常温特有の「タンパク質や水の動き」、 「酵素反応機構」が明らかとなることで、医薬品や機能性素材の設計開発など、医療や工業への幅広い応用も期待されます。
概要
XFELは試料への照射時間が10フェムト秒(1 フェムト秒は1,000兆分の1秒)以下という超短時間のため、タンパク質が壊れる前の微結晶の回折イメージを検出できます。このX線レーザーの特性を利用したタンパク質の構造決定法として、SFXが注目されています。SFX ではインジェクター(噴出装置)から噴出させた多数の微小結晶を含む試料にXFELを照射し、各結晶からの回折イメージを連続的に収集します。SFX は常温で解析を行うことができるため、従来の低温条件下(100K、-173度)で行う実験とは異なり、生理条件(生体内)に近く、常温で放射線損傷の影響がない構造が得られることや、フェムト秒からピコ秒の高い時間分解能で構造解析が可能であるという利点があります。
これまでSFXによる「創薬ターゲット蛋白質の迅速構造解析法の確立」課題を通し、2014年には、タンパク質結晶を高粘度物質のグリースに混ぜ、インジェクターからゆっくりと試料を押し出し、タンパク質結晶のX線回折実験を行うことができる「グリースマトリックス法」を開発しました。さらに2016年にはグリースに替わる新しい輸送媒体(ヒアルロン酸)も見出しています。この手法確立により、常温で放射線損傷の影響がない構造データの収集、新規タンパク質の立体構造決定をはじめ、時分割解析によりタンパク質の動的構造変化を捉える研究が可能となりました。しかしながら、原子分解能での精度の高い構造解析には成功していませんでした。
現在、XFEL解析施設として、米国のXFEL施設LCLSと日本のSACLAが稼働していますが、米国のLCLS施設に比べて、SACLAでは高エネルギーX線が使用可能である点が大きな特徴です。本研究グループは、X線自由電子レーザー施設SACLAの高エネルギーX線(13keV、ビームラインはBL3を使用)を用いた連続フェムト秒結晶構造解析によって、プロテイナーゼKという酵素の「現時点」では唯一の原子分解能構造解析に成功しました。
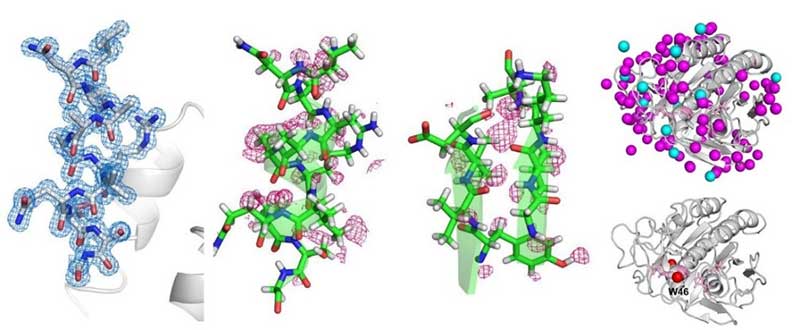
図:今回明らかになった「プロテイナーゼK」の構造
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.1038/srep45604
【KURENAIアクセスURL】 http://hdl.handle.net/2433/219505
Tetsuya Masuda, Mamoru Suzuki, Shigeyuki Inoue, Changyong Song, Takanori Nakane, Eriko Nango, Rie Tanaka, Kensuke Tono, Yasumasa Joti, Takashi Kameshima, Takaki Hatsui, Makina Yabashi, Bunzo Mikami, Osamu Nureki, Keiji Numata, So Iwata and Michihiro Sugahara.(2017). Atomic resolution structure of serine protease proteinase K at ambient temperature. Scientific Reports, 7, 45604.





