三芳秀人 農学研究科教授らの研究グループは、米国・レンセラー工科大学と共同で、コレラ菌など一部の病原性細菌のエネルギー代謝に必須の酵素(ナトリウム輸送性NADH-キノン酸化還元酵素、以下、NQR)へ阻害剤が結合している部位を初めて明らかにしました。加えて、酵素が働きかける物質であるキノンと酵素との結合部位も明らかにしました。対象とした酵素とよく似た酵素がヒトのミトコンドリアにも存在するため、病原性細菌の酵素にのみ効果を発揮する殺菌剤は開発が進んでいませんでした。今回の成果で阻害剤と酵素の結合部位が判明したため、今後NQRを標的とする創薬研究の進展が期待されます。
本研究成果は、2017年3月15日にアメリカ生化学・分子生物学会の学会誌「Journal of Biological Chemistry」に掲載され、同誌のEditor’s Picksに選ばれました。
研究者からのコメント
現在、レンセラー工科大学のグループは、オーラシン(これまで知られていた阻害剤よりも約1000倍も強力な阻害剤)を結合させた状態のNQRのX線結晶構造解析を進めています。これらの情報と今回の研究成果を組み合わせて、さらに詳細な結合部位の構造情報を明らかにすることができれば、NQRを標的とする創薬研究を具体的に進めることが期待できます。
概要
NQRは、細菌の細胞膜に存在する電子伝達酵素で、1977年にコレラ菌で初めて発見されました。その後、一部の海洋性細菌や病原性細菌でも発見され、現在では約100種類の細菌でその存在が知られています。NQRは細胞膜を介してナトリウムを能動輸送し、形成されたナトリウムの濃度勾配は、エネルギー(ATP)生産や鞭毛運動の駆動力として必須です。そのため、NQRを阻害する化合物は細菌のエネルギー代謝全般を遮断するため、有望な殺菌剤として期待されます。しかし、ヒトのミトコンドリアにも類似の電子伝達酵素が存在しますので、細菌のNQRのみを選択的に阻害する化合物の開発が期待されています。そのためには、阻害剤がNQRのどこに結合するのかを含め、本酵素の基礎研究の進展が期待されてきました。
NQRの基礎研究を進展させるにあたって、阻害剤や基質であるキノンがどこに結合するのかを明らかにすることは必須です。2014年にドイツのグループがコレラ菌NQRのX線結晶構造をネイチャー誌に発表しましたが、この構造中では阻害剤もキノンも結合していなかったため、これらの結合部位は謎のままでした。また、2017年に米国のグループが阻害剤の結合部位を提案しましたが、結果的にこの情報は間違っていました。
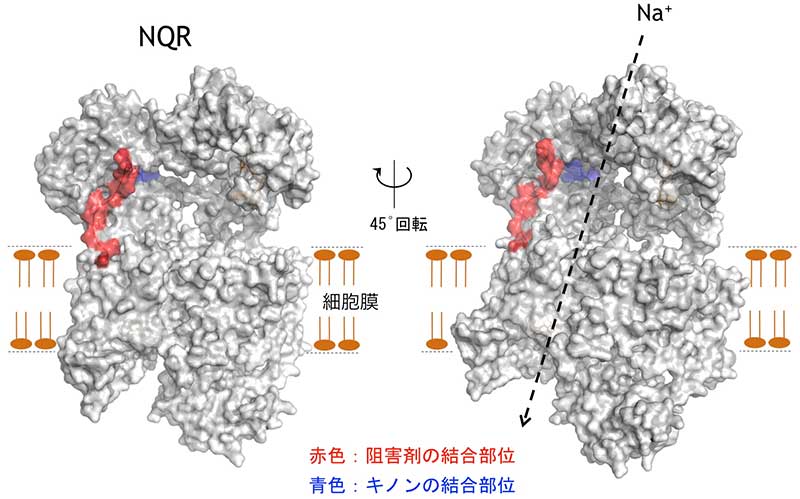
そこで本研究グループは、オーラシンを用いて、結合部位を直接的に調べることができる有機化学的手法(光親和性標識法)により、阻害剤やキノンの結合部位を初めて明らかにしました。NQRが働くとき、酵素内を電子が複雑な経路で流れるのですが、その終着点であるキノンの結合部位が明らかになったことにより、電子が流れる全体の経路が完成しました。また、阻害剤の結合部位は、キノン結合部位に隣接する場所にあるものの、両者は重なっていないことがわかりました。他の電子伝達酵素では両者が同一であることが一般的であるため、これがNQRの特徴であることがわかりました。これらの成果により、薬剤開発(ドラッグデザイン)を進めるための基礎的知見が確立しました。
詳しい研究内容について
書誌情報
【DOI】 https://doi.org/10.1074/jbc.M117.781393
Takeshi Ito, Masatoshi Murai, Satoshi Ninokura, Yuki Kitazumi, Katherine G. Mezic, Brady F. Cress, Mattheos A. G. Koffas, Joel E. Morgan, Blanca Barquera, and Hideto Miyoshi.(2017). Identification of the Binding Sites for Ubiquinone and Inhibitors in the Na+-Pumping NADH-Ubiquinone Oxidoreductase of Vibrio cholerae by Photoaffinity Labeling. Journal of Biological Chemistry, 292, 7727-7742.





