高田昌彦 霊長類研究所教授、井上謙一 同助教らの研究グループは、国立研究開発法人量子科学技術研究開発機構、米国国立精神衛生研究所と共同で、サルの脳内に発現させた人工受容体を生体で画像化する技術を世界で初めて確立するとともに、標的脳部位に人工受容体が発現していることを確認したサルに、人工受容体に作用する薬剤を全身投与し、価値判断行動を変化させることに成功しました。
本研究成果は、2016年12月6日午後7時に「Nature Communications」に掲載されました。
研究者からのコメント
本研究成果により、霊長類の脳において遺伝子導入によって発現させた人工受容体を画像化する技術が確立されました。サルではこれまで難しかった、特定の脳部位を非侵襲的に、一定時間、繰り返し操作するという神経活動制御を効率的かつ高精度に実施できるようになることから、サルを用いた高次脳機能研究の飛躍的な進展が期待されます。また、人工受容体遺伝子を精神・神経疾患の原因となる神経細胞群に導入して、症状が出たときにだけ薬で抑えるような、画期的治療法の開発が期待でき、臨床応用の観点からも本研究成果の意義は極めて大きいと考えられます。
本研究成果のポイント
- PET(陽電子断層撮影法)による画像化により、生きたサルの脳内で人工受容体が発現する位置や範囲を経時的に観察する世界初の技術の確立に成功
- 人工受容体が標的部位に発現していることを確認したサルに、特定の薬剤を全身投与することで価値判断行動を変化させることに成功
- ヒトを含む霊長類の高次脳機能研究の加速化や、精神・神経疾患に対する新たな遺伝子治療法の開発に寄与
概要
脳には特定の機能を担当する神経細胞集団からなる「神経核」とよばれる多数の部位があり、それらの部位が協調して働くことで判断や意思決定などさまざまな高次脳機能を生み出しています。この仕組みが破綻して精神・神経疾患などの病態を示すことから、特定の脳部位の神経活動を操作することによって変化する機能を同定することが重要です。
この目的のため、実験動物の特定の脳部位の神経細胞集団に「スイッチ」の役割をする人工受容体タンパク質を遺伝子導入技術により発現させ、その受容体にだけ作用する薬で神経活動を局所的に操作する手法がさまざまな研究に用いられてきました。しかし、従来、標的となる神経細胞集団に狙い通り受容体が発現しているかを確認するためには、すべての実験終了後に脳組織標本を作製して確認するしか手段がありませんでした。特にヒトに近いサルを対象とした実験では、利用できる個体数が限られることもあり、人工受容体を発現させるような遺伝子導入技術を利用して脳機能操作に成功した研究例はごく少数でした。
そこで本研究グループは、人工受容体遺伝子を組み込んだウイルスベクター(ウイルスが持つ細胞への感染性を利用し、病原性に関する遺伝子に代わり外来の目的遺伝子を組み込んだもの)をサルの特定の脳部位の神経細胞集団に感染させ、発現した人工受容体をPETにより画像化し、発現のタイミングや位置、範囲、強さを生きたまま評価することに成功しました。
さらに、脳深部にある、運動機能や意思決定などに関与する線条体という構造の一部の神経細胞群に人工受容体を発現させ、受容体に作用する薬剤を全身投与し神経活動を「スイッチ・オフ」にしたところ、それまでサルが問題なくこなしていた報酬量に基づく「価値判断」に関わる行動が障害されたことから、この線条体領域が価値判断を担っていることが確認できました。
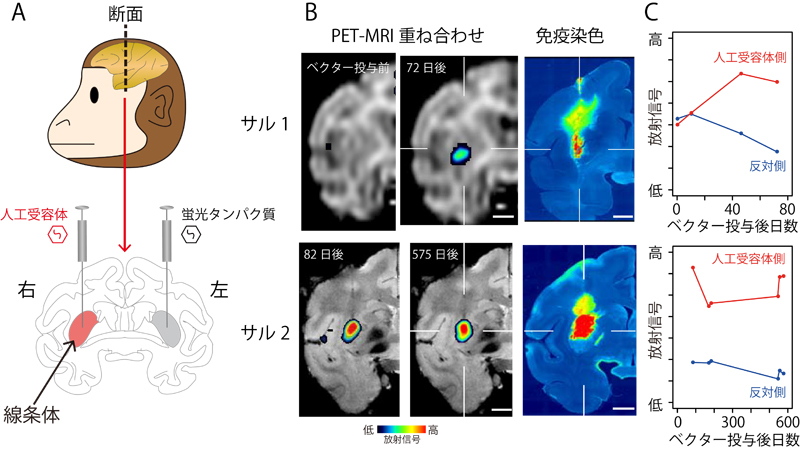
図:サルの脳内に発現した人工受容体のPETによるイメージング
(A) 人工受容体遺伝子を発現するウイルスベクターを投与した部位。(B) ウイルスベクター投与後、経時的な人工受容体発現をPETで画像化したもの(右脳のみ表示)。免疫染色標本と比較したところ、実際の発現位置および範囲がほぼ一致することがわかった。(C) 人工受容体発現レベルの経時的変化。約1.5ヶ月でピークに達し、約1.5年後まで維持されていた。
詳しい研究内容について
書誌情報
【DOI】 http://dx.doi.org/10.1038/ncomms13605
【KURENAIアクセスURL】 http://hdl.handle.net/2433/217627
Yuji Nagai, Erika Kikuchi, Walter Lerchner, Ken-ichi Inoue, Bin Ji, Mark A.G. Eldridge, Hiroyuki Kaneko, Yasuyuki Kimura, Arata Oh-Nishi, Yukiko Hori, Yoko Kato, Toshiyuki Hirabayashi, Atsushi Fujimoto, Katsushi Kumata, Ming-Rong Zhang, Ichio Aoki, Tetsuya Suhara, Makoto Higuchi, Masahiko Takada, Barry J. Richmond & Takafumi Minamimoto. (2016). PET imaging-guided chemogenetic silencing reveals a critical role of primate rostromedial caudate in reward evaluation. Nature Communications, 7:13605.





