漆谷真 医学研究科准教授、内田司 元同博士課程学生(現洛和会音羽病院神経内科医師)、伊東秀文 和歌山県立医科大学教授らのグループは共同研究で、神経難病である筋萎縮性側索硬化症の原因蛋白質の異常構造を特異的に認識して分解する仕組みと、その破綻がオリゴデンドロサイトというグリア細胞の病的封入体形成に関与している可能性を見出しました。
本研究成果は、英国科学誌「Scientific Reports」誌に掲載されました。
研究者からのコメント

左から漆谷准教授、内田元博士課程学生、伊東教授
オリゴデンドロサイトの機能異常は近年ALS病態の重要な病態として注目されており、VHL/CUL2の調節異常の解明が今後の治療開発における有望な治療標的として期待ができます。また我々が特定した異常なTDP-43の目印(246番グルタミン酸)は、分子標的治療や診断プローブの開発にも有用と考えています。
概要
筋萎縮性側索硬化症(ALS)は最も重篤な神経難病の一つですが病態は未だに不明で、根治的な治療法も存在しません。しかし以前からALSの病巣に異常凝集物が蓄積する現象は知られており、近年TDP-43という蛋白質が主な成分と判明したことから治療標的として注目を浴びています。
今回本研究グループは、がん関連蛋白質von Hippel Lindau(VHL)とCullin2(CUL2)からなるユビキチンリガーゼ複合体が、ALSで出現する病的なTDP-43と結合し、ユビキチン化とプロテアソームでの分解を促進することを発見した。さらにその仕組みの破綻が神経細胞周囲のグリア細胞であるオリゴデンドロサイトにおける病的封入体形成に関与していることを明らかにしました。オリゴデンドロサイトの機能異常は近年ALS病態の重要な要素として注目されており、VHL/CUL2の調節異常の解明はALS病態の解明と治療開発への道を開くものと期待ができます。
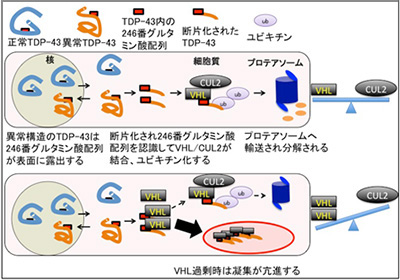
異常TDP-43のVHL/CUL2による認識と分解、VHL過剰時における凝集亢進
詳しい研究内容について
書誌情報
[DOI] http://dx.doi.org/10.1038/srep19118
[KURENAIアクセスURL] http://hdl.handle.net/2433/203055
Tsukasa Uchida, Yoshitaka Tamaki, Takashi Ayaki, Akemi Shodai, Seiji Kaji, Toshifumi Morimura, Yoshinori Banno, Kazuchika Nishitsuji, Naomi Sakashita, Takakuni Maki, Hirofumi Yamashita, Hidefumi Ito, Ryosuke Takahashi & Makoto Urushitani
"CUL2-mediated clearance of misfolded TDP-43 is paradoxically affected by VHL in oligodendrocytes in ALS"
Scientific Reports 6, Article number: 19118 Published online: 11 January 2016
- 京都新聞(1月12日 20面)に掲載されました。





