掛谷秀昭 薬学研究科教授、石川文洋 同特定助教らの研究グループは、有用なペプチド性天然化合物の合成酵素である非リボソーム性ペプチド合成酵素のアデニレーション(A)ドメインを標的にする合成小分子プローブ群を創出し、これらプローブ群を固定化することで、Aドメインの酵素機能(基質特異性)を迅速、簡便、かつ高感度に検出可能なELISA法を開発しました。これにより、自由自在にAドメインの基質特異性を設計することが可能となり、非天然化合物の創出や複雑天然化合物の誘導体化が可能になり、創薬シーズ開発の加速が期待されます。
本研究成果は、2015年10月16日に米国科学誌「ACS Chemical Biology」にオンライン掲載されました。
研究者からのコメント

左から掛谷教授、石川特定助教
今後、本ELISA法を基盤とする高速Aドメイン進化分子工学技術を開発し、望む基質特異性を有するAドメインを創出したいと考えています。天然の20種類のアミノ酸だけでなく、天然には存在しない基質特異性を有するAドメインを設計することに道を拓き、新しい非天然ペプチド性有機化合物の創出につながると考えています。
概要
微生物が産生するペプチド性天然有機化合物は、構造上極めて多様性に富み、強力な生物活性を有することから重要な研究ツールとなり創薬シーズとなっています。近年、これらの酵素システムを人為的に改変し、非天然化合物を創出する試みが多数報告されていますが、タンパク質工学的手法が成熟しつつある今日においても容易ではありません。一因として、Aドメイン変異体ライブラリーから望む基質特異性を有するAドメインを迅速に選別する明確な手法が確立されていない点が挙げられます。
今回の研究では、抗生物質グラミシジンSの生合成に関与するNRPS(GrsA)、抗生物質チロシジンの生合成に関与するNRPS(TycA, TycB1)、タンパク質分解酵素カルパイン阻害剤アウレウシミンの生合成に関与するNRPS(AusA2)、鉄キレーター(シデロフォア)エンテロバクチンの生合成に関与するNRPS(EntE)のAドメインを標的タンパク質としました。まず、Aドメインに高い親和性を有するアミノアシル-AMS-ビオチンを創製し、これら化合物のビオチン官能基を利用し, ストレプトアビジンを吸着したプレートにプローブ群を固定化したAドメインに対するELISA 法の構築を行いました(図)。これにより、Aドメイン変異体ライブラリーから設計した酵素機能を有するAドメインを取得するための確固たる基盤技術が構築できました。
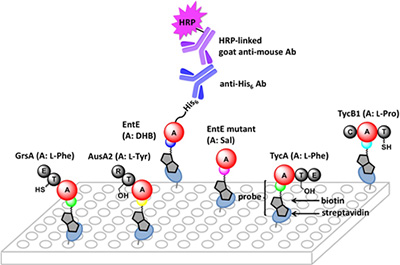
合成小分子プローブ群を固定化したアデニレーション(A)ドメインに対するELISA法のイメージ図
合成小分子プローブ群のビオチン官能基を利用することで、ストレプトアビジンを吸着したプレートに固定化することができます。このAドメインに対するELISA法は、大腸菌組換えタンパク質のタグ分子(His6)を利用し、一次抗体として抗タグ抗体を、二次抗体として西洋わさび由来のペルオキシダーゼを縮合した抗マウス抗体を組み合わせる間接ELISA法を採用しています。これにより、合成小分子プローブ(アミノアシル-AMS-biotin プローブ; アミノアシル-AMSは 5'- O - N -(aminoacyl)sulfamoyladenosineを示す)のリガンド部位(色丸)に基質特異性(酵素活性)を有するAドメインの迅速、簡便、高感度な検出を実現しました。GrsA、TycA、TycB1、AusA2、EntEはNRPSタンパク質で、それぞれL-Phe、L-Phe、L-Pro、L-Tyr、2,3-ジヒドロキシ安息香酸(DHB)に基質特異性をもつAドメイン(赤色)を有しています。その他の酵素ドメインは、担体タンパク質(T)、異性化酵素(E)、縮合酵素(C)、還元酵素(R)で表示しています。
詳しい研究内容について
書誌情報
[DOI] http://dx.doi.org/10.1021/acschembio.5b00595
Fumihiro Ishikawa, Kengo Miyamoto, Sho Konno, Shota Kasai, and Hideaki Kakeya
"Accurate Detection of Adenylation Domain Functions in Nonribosomal Peptide Synthetases by an Enzyme-linked Immunosorbent Assay System Using Active Site-directed Probes for Adenylation Domains"
ACS Chemical Biology, Publication Date (Web): October 16, 2015





